Природная вода (артезианская, грунтовая, из поверхностных источников) содержит
в себе растворенные минералы, как правило, это соли различных металлов. Основными
соединениями, растворенными в воде, являются катионы натрия, калия, магния, кальция
(Na+, K+, Mg2+, Ca2+) и анионы хлора, сульфаты и гидрокарбонаты (Cl-, SO42-, HCO3-).
Когда речь заходит о питьевом водоснабжении, то, как правило, воду классифицируют
по классу жесткости. В соответствии с СанПиН 2.1.4.1074-01 [1] жесткость питьевой воды
должна быть не более 7 мг-экв/л, однако, в соответствии с DIN 19643, такая вода считается
уже очень жесткой.
Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами
кальция и магния Са(НСО3)2; Mg(НСО3)2, и постоянную (некарбонатную) жёсткость,
вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном,
сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Все дело в том, что различные соединения имеют различную растворимость в воде,
так их растворимость меняется при изменении термодинамических условий: давления,
температуры. При неизменных условиях (давлении, температуре) водный раствор
(минеральная вода) находится в состоянии равновесия, как и любая система. Однако, при
изменении условий химическое равновесие нарушится и в воде пойдут процессы, которые
призваны найти новую точку равновесия. Одним из способов нарушения равновесия
является нагрев или кипячение.
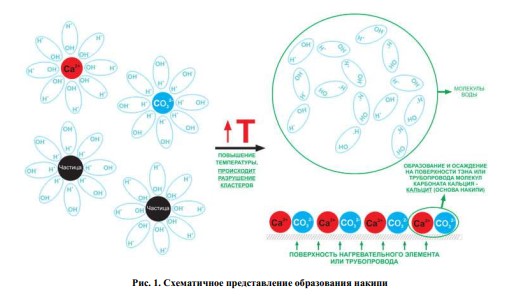
Процесс образования накипи при нагревании можно описать следующим образом.
В природном состоянии ионы растворенных в воде соединений находятся в гидратных
оболочках, образование которых связано с тем, что молекула воды несимметрична
и обладает дипольным моментом, т.е. сторона молекулы, куда смещены атомы водорода
имеет положительный заряд, а сторона с атомом кислорода – отрицательный, и, поэтому
молекулы воды как бы прилипают к ионам растворенных в воде соединений. При нагревании
воды усиливается тепловое движение молекул, в результате чего происходит деформация
и разрушение гидратных оболочек ионов растворенных в воде соединений, что ведет к
снижению гидратации. В результате на поверхностях нагрева протекает реакция
преобразования растворенного в воде гидрокарбоната кальция Са(НСО3)2 в нерастворимый
карбонат кальция CaCO3 и угольную кислоту H2CO3, которая в водных растворах
неустойчива и распадается на воду и углекислый газ. Этот процесс (рис. 1) можно описать
следующей химической реакцией:
Ca2+ + 2HCO3- ↔ CO2(aq) + CaCO3(s) + H2O.
При этом образующийся карбонат кальция выпадает в осадок на неровностях
поверхностей нагрева (нагреваемых стенках посуды, стенках газовых котлов или, в случае
электрических котлов, на ТЭНах). Выпадающий на горячей поверхности карбонат кальция
образуется в форме кальцита (одной из полиморфных модификаций карбоната кальция),
который отличается высокой адгезией (прилипанием) и в результате создает слой накипи.
При этом из-за того, что теплопроводность накипи намного ниже, чем у металла, время
на нагрев воды значительно увеличивается, а нагревательные элементы начинают работать
в условиях перегрева. Все это приводит к ускоренному износу оборудования и значительным
потерям энергии. Величина потерь энергии зависит от свойств накипи – минеральный
состав, пористость, адгезия к поверхности, но, как правило, потери энергии составляют
3 – 8 % на каждый миллиметр накипи.
Как правило, накипь образуется из-за выпадения в осадок карбоната кальция CaCO3,
на практике это около 98 % случаев.
Существуют различные способы борьбы с накипью. Их основная задача – снизить
жесткость (умягчение) воды, что предотвратит образование накипи и снизит потери энергии
нагрева, продлит срок службы оборудования и увеличит межремонтный интервал.
Умягчение воды (снижение накипеобразования) может быть осуществлено следующими
основными способами: реагентным, катионитовым, термическим, ультразвуковым,
электромагнитным (магнитным).
Одним из самых эффективных и дешевых является магнитная или электромагнитная
обработка воды. Электромагнитная обработка воды как средство борьбы с накипью и
коррозией получила известность еще в 1945 году (бельгийский патент № 460560, выданный
Т. Вермайрену). Однако, в России подобные системы защиты от накипи не получили
широкого распространения [2 – 5].
Нами разработан противонакипный прибор (заявка на полезную модель
№ 2017115615/20(027072) от 03.05.2017 [6]), работа которого основана на усовершенствовании электромагнитного принципа обработки воды электромагнитными импульсами
для предотвращения образования накипи.
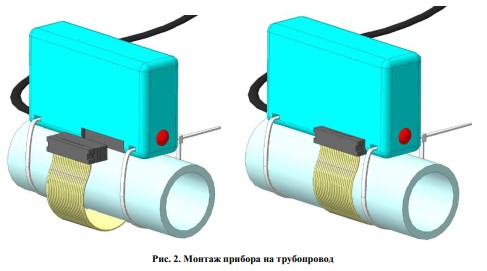
Конструктивно прибор для электромагнитной обработки воды состоит из корпуса
с размещенным в нем генератором электромагнитных импульсов, контактных разъемов
и многожильного плоского кабеля. При монтаже устройства замыкаются половинки
контактных разъемов, образуя из многожильного плоского кабеля катушку индуктивности
с числом витков по числу жил кабеля. Устройство устанавливается на трубопровод без
разборки последнего, и может быть зафиксировано, например, хомутами. Внешний вид
прибора и его монтаж на трубопровод представлены на рис. 2.
Механизм воздействия переменного электромагнитного поля на воду можно описать
следующим образом:
- как было сказано выше, ионы растворенных в воде соединений находятся в гидратных
оболочках, образование которых связано с тем, что молекула воды обладает дипольным
моментом, т.е. сторона молекулы, куда смещены атомы водорода имеет положительный
заряд, а сторона с атомом кислорода – отрицательный, и, поэтому молекулы воды как бы
прилипают к ионам растворенных в воде соединений;
- под действием переменного электромагнитного поля электрически заряженная
частица (ионы растворенных солей или молекулы воды, имеющие два центра с
положительным и отрицательным зарядами) подвергается силе Лоренца, в результате чего
происходит деформация и разрушение гидратных оболочек ионов растворенных в воде
соединений, что ведет к снижению гидратации и повышению возможности сближения и
агрегации;
- в результате в объеме воды при протекании реакции преобразования растворенного
в воде гидрокарбоната кальция Са(НСО3)2 в CaCO3 и угольную кислоту H2CO3 достаточно
легко образуются центры фазовых превращений карбоната кальция с дальнейшим
образованием кристаллов CaCO3 в потоке воды. При этом карбонат кальция образуется
в форме арагонита (еще одной из полиморфных модификаций карбоната кальция), который
не имеет высокой адгезии и в результате легко выносится из системы (теплообенника)
с потоком воды в виде микроразмерных кристаллов.
Несущественное отличие в принципе и месте разрушения гидратных оболочек и,
соответственно, месте протекания реакции образования карбоната кальция, приводит
к серьёзному различию получаемого результата. Дело в том, что кристаллический карбонат
кальция имеет в природе несколько различных полиморфных модификаций (кристаллы,
отличающиеся структурой кристаллической решетки), основными являются кальцит и
арагонит. Различие в структуре кристаллической решетки приводит к существенному
различию в физических свойствах. Арагонит имеет большую плотность и температуру
плавления. Но главным обстоятельством является то, что адгезионные свойства,
определяющие способность к слипанию и прилипанию к поверхностям конструкций, выше
у кальцита, т.к. он имеет более развитую поверхность кристаллов (рис. 3, а) в отличие от
арагонита (рис. 3, б).

Так вот на горячей поверхности (ТЭНы, теплообменники) образуется кальцит, который
и создает слой накипи, а при гомогенной кристаллизации (образовании центров фазовых
превращений) в объеме воды, что имеет место при (электро)магнитной обработке,
образуется арагонит. Кристаллы арагонита, образовавшиеся в результате электромагнитной
обработки воды, не прилипают к стенкам конструкции и выносятся с потоком.
Исследованиям гомогенной кристаллизации карбоната кальция CaCO3 при
электромагнитной обработке воды посвящен ряд работ зарубежных авторов [8, 9], в которых
приведены результаты экспериментальных и теоретических исследований.
Таким образом, электромагнитная обработка предотвращает образование накипи,
однако у этого воздействия есть еще один эффект – удаление уже существующей накипи.
Дело в том, что большинство химических реакций обратимы при изменении
термодинамических условий, если не разъединить вещества участвующие в реакции.
Как было отмечено выше, карбонат кальция образуется в результате реакции преобразования
растворенного в воде гидрокарбоната кальция в СаСО3, образующийся в результате которой
углекислый газ при наличии свободной поверхности (контакта с воздухом) улетучивается из
воды, т.е. вещества, участвующие в реакции, разделяются. Однако, если дело происходит
в трубе, когда углекислому газу некуда выйти (нет контакта воды с воздухом), в воде
происходит образование угольной кислоты:
CO2 + H2O ↔ H2CO3.
Это слабая кислота и, как отмечено выше, неустойчивое соединение. Но при
отсутствии открытой поверхности, когда у углекислого газа нет возможности улетучиться из
воды, эта кислота существует. И, соответственно, реакция образования карбоната кальция
может пойти в обратную сторону, т.е. угольная кислота начнет растворять уже
существующий карбонат кальция.
При этом следует отметить, что в природе наибольшее распространение получил
кальцит, и это связано с тем, что энергия образования его меньше, чем у арагонита.
Следовательно, и энергия его разложения так же меньше. Таким образом, находящаяся
в воде угольная кислота в первую очередь начнет растворять не арагонит, а кальцит,
из которого и состоит накипь.
Здесь еще раз необходимо отметить, что угольная кислота – слабая, а накопившийся
слой накипи может быть достаточно толстым, поэтому для появления эффекта (заметного
улучшения работы водогрейного котла) должно пройти достаточно длительное время –
от нескольких дней до двух-трех месяцев. Кроме того, многое зависит и от используемой
воды.
Разработанный прибор прошел испытания на Ижевском заводе тепловой техники.
22 марта 2017 г. был взят бытовой электрический водонагреватель, проработавший 2 месяца.
На трубе перед входом холодной воды установлен прибор для электромагнитной обработки
воды и подключен к сети 220 – 230 В через блок питания. Водонагреватель был подключен
к системе водоснабжения, заполнен и включен на полную мощность. Каждые 4 часа
с водонагревателя сливали горячую воду и заполняли его холодной. Испытания проводились
в течение недели. По истечении недели вода с водонагревателя была слита через плотную
ткань для оценки шлака и накипи. После проведения испытаний в течение месяца
водонагреватель был оставлен на 2 месяца прогона, при этом вода так же сливалась, но ТЭН
не извлекался. 28 июня 2017 г. был произведен разбор и оценка изменений состояния ТЭНа.
ТЭН был очищен при помощи протирания его поверхности рукой под слабой струей воды.
Внешний вид ТЭНа до и после испытаний приведен на фото (рис. 4)

Таким образом, после 3 месяцев испытаний налет на ТЭНе стал мягким, его можно
удалить руками, протерев поверхность ТЭНа, не прилагая больших усилий.
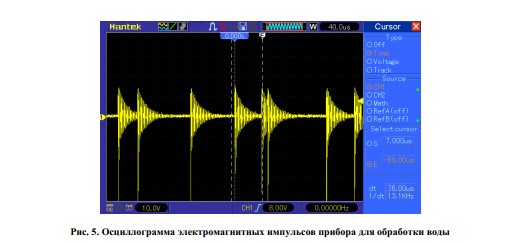
Еще одной особенностью прибора является использование для обработки воды
импульсного воздействия, т.е. электромагнитное поле прибора действует не постоянно,
а реализовано в виде затухающих импульсов, следующих с переменной частотой (рис. 5).
Это позволяет существенно снизить энергопотребление прибора – до 1 Вт.
Таким образом, электромагнитное воздействие на воду позволяет разрушить
гидратацию ионов, растворенных в воде солей, вследствие чего кристаллизация карбоната
кальция протекает в воде по гомогенному механизму с образованием арагонита, который
не прилипает к стенкам нагревательных элементов и не образует накипь.
МЕЛЬНИКОВ М. В., КОРЕПАНОВ М. А., 3КАЛИНИН А. С.
ООО «Экосистемы», 426000, г. Ижевск, ул. К. Маркса, 437, литер в, офис 5
Институт механики Уральского отделения РАН, 426067, г. Ижевск, ул. Т. Барамзиной, 34
ООО ТПК «ЭнергоСветПрогресс», 426063, г. Ижевск, ул. Мельничная, 45, офис 1
Так вот на горячей поверхности (ТЭНы, теплообменники) образуется кальцит, который
и создает слой накипи, а при гомогенной кристаллизации (образовании центров фазовых
превращений) в объеме воды, что имеет место при (электро)магнитной обработке,
образуется арагонит. Кристаллы арагонита, образовавшиеся в результате электромагнитной
обработки воды, не прилипают к стенкам конструкции и выносятся с потоком.
Исследованиям гомогенной кристаллизации карбоната кальция CaCO3 при
электромагнитной обработке воды посвящен ряд работ зарубежных авторов [8, 9], в которых
приведены результаты экспериментальных и теоретических исследований.
Таким образом, электромагнитная обработка предотвращает образование накипи,
однако у этого воздействия есть еще один эффект – удаление уже существующей накипи.
Дело в том, что большинство химических реакций обратимы при изменении
термодинамических условий, если не разъединить вещества участвующие в реакции.
Как было отмечено выше, карбонат кальция образуется в результате реакции преобразования
растворенного в воде гидрокарбоната кальция в СаСО3, образующийся в результате которой
углекислый газ при наличии свободной поверхности (контакта с воздухом) улетучивается из
воды, т.е. вещества, участвующие в реакции, разделяются. Однако, если дело происходит
в трубе, когда углекислому газу некуда выйти (нет контакта воды с воздухом), в воде
происходит образование угольной кислоты:
CO2 + H2O ↔ H2CO3.
Это слабая кислота и, как отмечено выше, неустойчивое соединение. Но при
отсутствии открытой поверхности, когда у углекислого газа нет возможности улетучиться из
воды, эта кислота существует. И, соответственно, реакция образования карбоната кальция
может пойти в обратную сторону, т.е. угольная кислота начнет растворять уже
существующий карбонат кальция.
При этом следует отметить, что в природе наибольшее распространение получил
кальцит, и это связано с тем, что энергия образования его меньше, чем у арагонита.
Следовательно, и энергия его разложения так же меньше. Таким образом, находящаяся
в воде угольная кислота в первую очередь начнет растворять не арагонит, а кальцит,
из которого и состоит накипь.
ХИМИЧЕСКАЯ ФИЗИКА И МЕЗОСКОПИЯ. 2017. Том 19, №3 393
Здесь еще раз необходимо отметить, что угольная кислота – слабая, а накопившийся
слой накипи может быть достаточно толстым, поэтому для появления эффекта (заметного
улучшения работы водогрейного котла) должно пройти достаточно длительное время –
от нескольких дней до двух-трех месяцев. Кроме того, многое зависит и от используемой
воды.
Разработанный прибор прошел испытания на Ижевском заводе тепловой техники.
22 марта 2017 г. был взят бытовой электрический водонагреватель, проработавший 2 месяца.
На трубе перед входом холодной воды установлен прибор для электромагнитной обработки
воды и подключен к сети 220 – 230 В через блок питания. Водонагреватель был подключен
к системе водоснабжения, заполнен и включен на полную мощность. Каждые 4 часа
с водонагревателя сливали горячую воду и заполняли его холодной. Испытания проводились
в течение недели. По истечении недели вода с водонагревателя была слита через плотную
ткань для оценки шлака и накипи. После проведения испытаний в течение месяца
водонагреватель был оставлен на 2 месяца прогона, при этом вода так же сливалась, но ТЭН
не извлекался. 28 июня 2017 г. был произведен разбор и оценка изменений состояния ТЭНа.
ТЭН был очищен при помощи протирания его поверхности рукой под слабой струей воды.
Внешний вид ТЭНа до и после испытаний приведен на фото (рис. 4)


















